Degrugillier F, Aissat A, Prulière-Escabasse V, Bizard L, Simonneau B, Decrouy X, Jiang C, Rotin D, Fanen P, Simon S. Phosphorylation of the Chaperone-Like HspB5 Rescues Trafficking and Function of F508del-CFTR.
Int J Mol Sci. 2020 Jul 8;21(14):E4844.
Amélie E.Coudert, François Redelsperger, Yasmine Chabbi-Achengli, Cécile Vernochet, Caroline Marty, XavierDecrouy, Thierry Heidmann, Marie-Christine de Vernejoul, Anne Dupressoir. Role of the captured retroviral envelope syncytin-B gene in the fusion of osteoclast and giant cell precursors and in bone resorption, analyzed ex vivo and in vivo in syncytin-B knockout mice
Bone Reports Volume 11, December 2019, 100214
Degrugillier F, Simon S, Aissat A, Remus N, Mekki C, Decrouy X, Hatton A, Hinzpeter A, Hoffmann B, Sermet-Gaudelus I, Callebaut I, Fanen P, Prulière-Escabasse V. Unsolved severe chronic rhinosinusitis elucidated by extensive CFTR genotyping.
Clin Case Rep. 2019 Sep 27;7(11):2128-2134.
Perla C. Reyes-Fernandez, Baptiste Periou, Xavier Decrouy, Fréderic Relaix and François Jérôme Authier. Automated image-analysis method for the quantification of fiber morphometry and fiber type population in human skeletal muscle
Skeletal Muscle, 2019, vol 9, 1-15
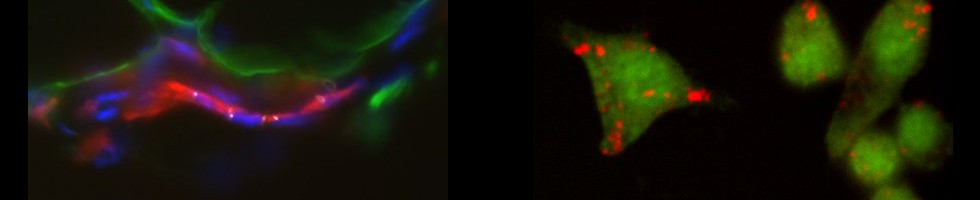
Aubatin A, Sako N, Decrouy X, Donnadieu E, Molinier-Frenkel V, Castellano F. IL4-induced gene 1 is secreted at the immune synapse and modulates TCR activation independently of its enzymatic activity.
Eur J Immunol. 2018 Jan;48(1):106-119
C. Delestrain, S. Simon, A. Aissat, R. Medina, X. Decrouy, E. Nattes, A. Tarze, B. Costes, P. Fanen and R. Epaud. Deciphering the mechanism of Q145H SFTPC mutation unmasks a splicing defect and explains the severity of the phenotype
European Journal of Human Genetics (2017) 25, 779–782
Loïc Drévillon, André Megarbane, Bénédicte Demeer, Corine Matar, Paule Benit, Audrey Briand-Suleau, Virginie Bodereau, Jamal Ghoumid, Mayssa Nasser, Xavier Decrouy, Martine Doco-Fenzy, Pierre Rustin, Dominique Gaillard, Michel Goossens and Irina Giurgea, KBP–cytoskeleton interactions underlie developmental anomalies in Goldberg–Shprintzen syndrome
Hum. Mol. Genet. (2013) 22 (12): 2387-2399.
Laura H. Okagaki , Anna K. Strain , Judith N. Nielsen, Caroline Charlier, Nicholas J. Baltes, Fabrice Chrétien, Joseph Heitman, Françoise Dromer, Kirsten Nielsen.
PLoS Pathog. 2010; 6:e1000953
Lara Khouzami, Marie-Claude Bourin, Christo Christov, Thibaud Damy, Brigitte Escoubet, Philippe Caramelle, Magali Perier, Karim Wahbi, Christophe Meune, Catherine Pavoine, Françoise Pecker. Delayed Cardiomyopathy in Dystrophin Deficient mdx Mice Relies on Intrinsic Glutathione Resource
Am J Pathol. 2010; 177: 1356-64
Shao-yu Zhang, Maud Kamal, Karine Dahan, André Pawlak, Virginie Ory, Dominique Desvaux, Vincent Audard, Marina Candelier, Fatima Ben Mohamed, Marie Matignon, Christo Christov, Xavier Decrouy, Veronique Bernard, Gilles Mangiapan, Philippe Lang, Georges Guellaën, Pierre Ronco, and Djillali Sahali. c-mip Impairs Podocyte Proximal Signaling and Induces Heavy Proteinuria
Sci. Signal., 18 May 2010, Vol. 3, Issue 122, p. ra39
S Terry, G Ploussard Y Allory, N Nicolaiew, F Boissière-Michot, P Maillé, L Kheuang, E Coppolani, A Ali, F Bibeau, S Culine, R Buttyan, A de la Taille, and F Vacherot. Increased expression of class III β-tubulin in castration-resistant human prostate cancer
British Journal of Cancer (2009) 101, 951–956. doi:10.1038/sj.bjc.6605245