Actualités

Historique
L’équipe a été créée en 2007 par le Pr Yves Lévy et étudie la physiopathologie du VIH depuis la recherche en amont jusqu’à la recherche translationnelle dans le domaine des interventions immunitaires et des vaccins.
L’activité de recherche de l’équipe est étroitement liée au département d’immunopathologie clinique. Ce département a été impliqué dans plus de 20 essais cliniques dans le domaine du VIH et des immunodéficiences primaires et plus de 1000 patients infectés par le VIH sont suivis dans ce département clinique.
En 2007, le département clinique a étendu son programme de recherche clinique en créant un centre clinique de vaccinologie contre le VIH visant à recruter des volontaires sains et à développer un programme d’essais cliniques de vaccin contre le VIH. Par conséquent, de nombreuses possibilités cliniques ont pu être disponibles, permettant ainsi au groupe de publier de nombreux articles sur le sujet des thérapies immunitaires et de la physiopathologie du VIH.
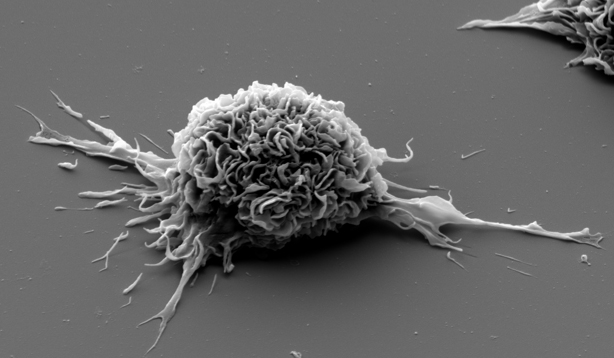
Dendritic cells matured ex vivo in presence of HIV lipopeptides (© Institut Pasteur, VRI)
Plus récemment, dans le cadre du programme de vaccin contre le VIH de l’ANRS (Agence nationale française de recherche sur le VIH et l’hépatite), l’équipe 16 a étendu sa capacité technologique et son expertise en créant une plate-forme (Le Centre d’immunologie de Mondor) visant à effectuer des dosages immunitaires à des étapes clés et à évaluer les réponses immunitaires humaines dans les essais cliniques d’immunothérapie et des vaccins.
En 2011, une nouvelle étape du programme de vaccination de l’ANRS a été atteinte par la création de l’Institut de recherche sur les vaccins (VRI), lauréat A + Labex « investissement d’avenir ». Y. Lévy en est le responsable et il coordonne le VRI au nom de l’ANRS et de l’UPEC. Le VRI est un Labex situé à l’Institut Mondor et comprend des équipes internes et externes qui ont pour mission de relever les défis de développer des vaccins efficaces contre le VIH et le VHC. Ce programme de recherche est mis en œuvre par un grand réseau de leaders d’opinion internationaux dans ce domaine à travers un réseau de collaborations unique et avec un plan stratégique central.
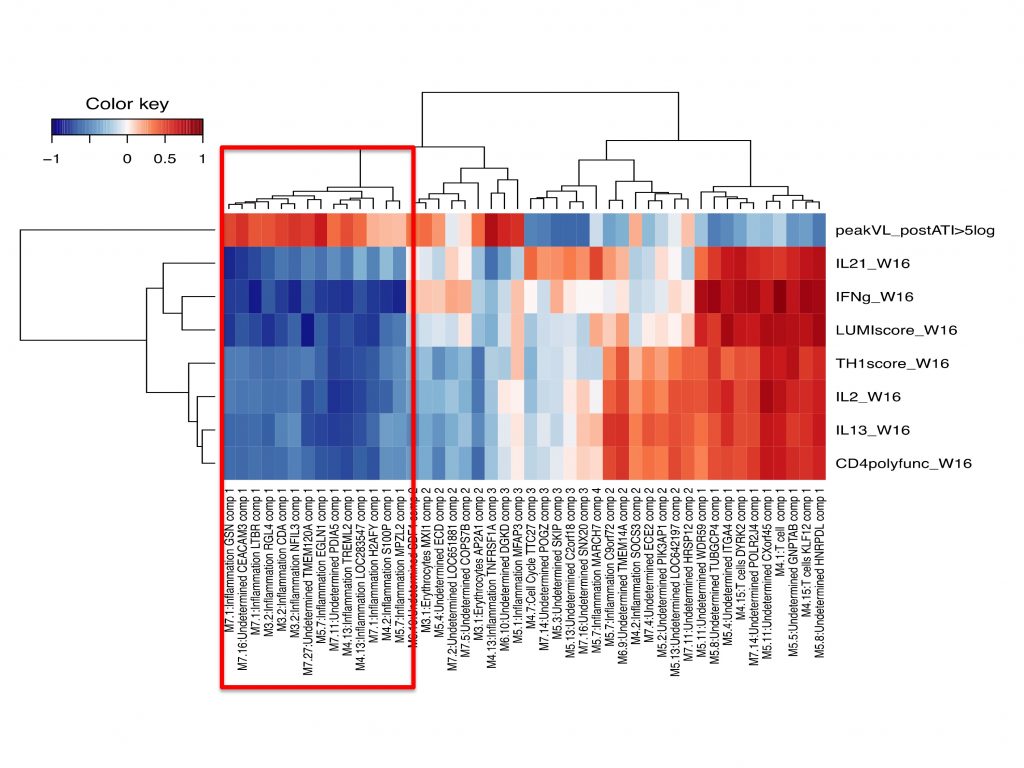
Correlations between vaccine-elicited immune responses and the magnitude of viral rebound post c-ART cessation in the anti HIV therapeutic trial DALIA (Transcriptomic analysis)
Plus spécifiquement, les objectifs de l’équipe sont de:
i) comprendre comment et pourquoi la physiopathologie du VIH reste un problème clinique majeur, malgré l’avènement de plusieurs générations de médicaments antiviraux puissants;
ii) développer des interventions immunitaires innovantes telles que les cytokines, les immunomodulateurs et les vaccins visant à prévenir l’infection par le VIH ou une pathologie persistante.
Notre stratégie est de développer des modèles in vitro, pour exploiter ce que nous pouvons apprendre du suivi de grandes cohortes de patients à différents stades de la maladie et à la suite des interventions immunitaires dans les études précliniques ou cliniques. Cette stratégie bénéficie également d’une approche à grande échelle permettant une grande exploration des hypothèses à partir de quantités limitées de matériel humain (sang, sérum, cellules, biopsies d’intestin et de peau) et de développer de nouveaux vaccins, dont la validation apporte également de nouvelles connaissances sur la physiologie et les corrélations entre immunité et protection.
Notre approche cherche à étudier les mécanismes de restauration immunitaire, les effets des stratégies de modulation immunitaire et les conséquences des interventions immunitaires.
Le programme de l’équipe comprend trois aspects principaux :
Restauration immunitaire (PI: Pr JD Lelièvre)
Cette partie du programme vise à poursuivre l’enquête sur les mécanismes impliquant l’IL-7 et Notch dans la génération des précurseurs thymiques précoces mais aussi les aspects de régulation de l’homéostasie des cellules T lors de l’infection par le VIH. Actuellement, les sujets développés ici sont :
1. L’interaction de Notch et IL7 dans le développement des cellules T.
2. L’analyse du potentiel de CD34 au cours de l’infection par le VIH.
3. La détermination du rôle de SAMHD1 dans les cellules T périphériques au cours de l’infection à VIH.
Régulation immunitaire (PI: Pr S Hue, Dr H Hocini, Dr C Lacabaratz, Pr JD Lelièvre)
Une grande partie de notre programme vise à comprendre la régulation des réponses effectrices des lymphocytes T avec un accent particulier sur les Treg dans la périphérie et sur les sites de la muqueuse chez les individus infectés par le VIH, co-infecté ou non par d’autres agents pathogènes. Les principaux thèmes développés actuels sont:
1. L’analyse de l’interaction entre la balance régulateurs/effecteurs et des lésions épithéliales chez les individus infectés par le VIH;
2. La réponse des cellules B et l’impact sur l’intégrité de l’intestin chez les patients infectés;
3. L’étude du rôle des cellules Treg dans la vaccination;
4. L’étude de la balance Treg/Th17 au cours de l’infection par Mycobacterium tuberculosis (bacille de Koch) chez les patients co-infectés ou non par le VIH
En collaboration avec le département clinique de dermatologie du CHU Henri Mondor (Pr O Chosidow, Pr P Wolkenstein) l’équipe effectue également des recherches sur l’hidrosadénite qui est utilisée comme un modèle d’inflammation de la peau et de perturbation de l’homéostasie des lymphocytes T.
Immuno-intervention (PI: Dr S Cardinaud, Pr V Godot, le Dr H Hocini, Dr C Lacabaratz, Pr JD Lelièvre, Dr G Scarlatti, Pr S. Hue)
Une partie de notre équipe VRI, en collaboration avec notre département clinique, est impliquée dans un vaste programme clinique visant à développer un premier vaccin prophylactique et thérapeutique en phases I/II, pour définir la meilleure stratégie qui sera développée en phase IIb / II. La stratégie du VRI pour la vaccination se concentre sur les cellules dendritiques en utilisant des anticorps spécifiques. Plus précisément, les sujets d’actualité développés sont :
1. L’étude des réponses d’anticorps au niveau des muqueuses lors de l’infection à VIH et de la vaccination;
2. L’étude du rôle de la protéine GILZ dans la biologie des cellules dendritiques et de son utilisation pour les améliorer;
3. L’étude de l’impact directe de protéines Env-anti-cellules dendritiques tant sur le phénotype que sur la fonction de ces cellules.
4. L’élaboration de tests de vaccins prophylactiques et thérapeutiques (département clinique)
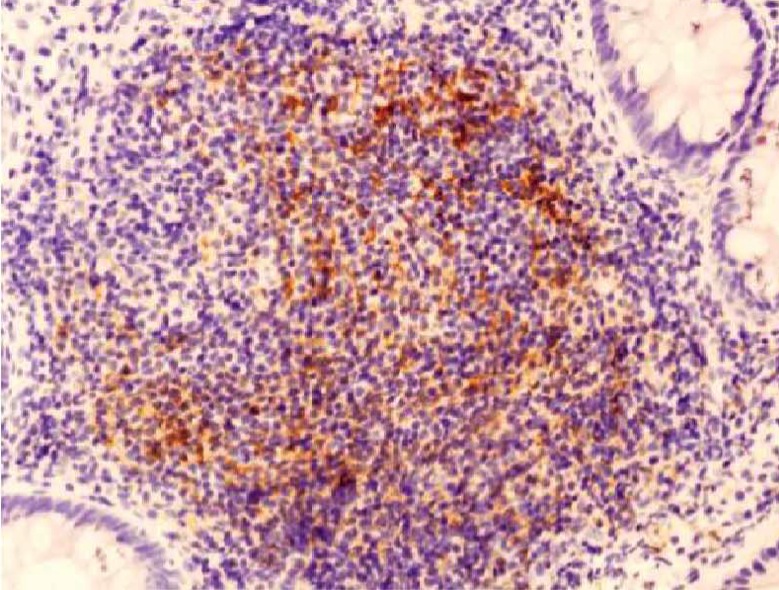
Histological aspect of the gut in an early treated patients showing a well-organized B-cell follicle containing a germinal center highlighted by a network of CD21+ FDC
Mots clé
VIH, vaccin, Treg, cellules dendritiques, GILZ, IL7, CD34, Notch, immunité des muqueuses, hidradenitis suppurativa
